Као нова у лабораторији, није добар посао издвојити позитивне биљке из гомиле биљака са ниском стопом конверзије.Прво, ДНК се мора издвојити из великог броја узорака један по један, а затим ће се страни гени открити ПЦР-ом.Међутим, резултати су често празнине и траке са неколико ставки повремено, али је немогуће утврдити да ли постоје пропуштене детекције или лажне детекције..Да ли је беспомоћно суочити се са таквим експерименталним процесом и резултатима?Не брини, брат те учи како да лако и прецизно одстрањујеш трансгене позитивне биљке.
Корак 1
Прајмери за детекцију дизајна
Одредите ендогени ген и егзогени ген који ће се детектовати према узорку који се тестира и изаберите репрезентативну секвенцу од 100-500 бп у гену за дизајн прајмера.Добри прајмери могу осигурати тачност резултата детекције и скратити време детекције (погледајте додатак за најчешће коришћене прајмере за детекцију).
Напомена: Ново дизајнирани прајмери треба да оптимизују реакционе услове и провере тачност, прецизност и границу детекције пре детекције великих размера.
Корак 2
Дизајн експерименталног протокола
Позитивна контрола: Користите пречишћену ДНК која садржи циљни фрагмент као шаблон да бисте утврдили да ли су ПЦР реакциони систем и услови нормални.
Негативна/празна контрола: Користите ДНК шаблон или ддХ2О који не садржи циљни фрагмент као шаблон да бисте открили да ли постоји извор контаминације у ПЦР систему.
Интерна референтна контрола: користите комбинацију прајмера/сонде ендогеног гена узорка који се тестира да бисте проценили да ли се шаблон може детектовати ПЦР-ом.
Објава:
Позитивне, негативне/празне контроле и интерне контроле треба да буду постављене за сваки тест да би се проценила валидност експерименталних резултата.
Припрема експеримента
Пре употребе, проверите да ли је раствор равномерно измешан.Уколико дође до падавина, пре употребе га је потребно растворити и промешати према упутству.2×ПЦР мешавину треба пипетирати и мешати више пута микропипетом пре употребе да би се избегла неравномерна дистрибуција јона.
Објава:
Извадите упутство и пажљиво га прочитајте, а пре експеримента извршите припреме строго у складу са захтевима приручника.
Корак 4
Припремите ПЦР реакциони систем
Према експерименталном протоколу, равномерно помешајте прајмере, Х2О и 2×ПЦР мешавину, центрифугирајте и распоредите их у сваку реакциону епрувету.
Објава:
За обимно или дуготрајно тестирање, препоручује се употреба ПЦР реакционог система који садржи УНГ ензим, који може ефикасно избећи контаминацију аеросола узроковану ПЦР производима.
Корак 5
Додајте шаблон за реакцију
Користећи директну ПЦР технологију, нема потребе за заморним процесом пречишћавања нуклеинске киселине, шаблон узорка се може припремити у року од 10 минута и може се додати одговарајући ПЦР реакциони систем.
Објава:
Метода цепања има бољи ефекат детекције, а добијени производ се може користити за вишеструке реакције детекције.
5.1: Директно ширење листова
Према величини слике у упутству, исећи ткиво листа пречника 2-3мм и ставити га у ПЦР реакцијски систем.
Напомена: Уверите се да су фрагменти листа потпуно уроњени у ПЦР реакциони раствор и немојте додавати превише ткива листа.
5.2: Метода цепања листа
Исеците ткиво листа пречника 5-7мм и ставите га у епрувету за центрифугу.Ако изаберете зрело лишће, избегавајте коришћење ткива главне вене листа.Одпипетирајте 50 ул пуфера П1 лизата у епрувету за центрифугирање да бисте осигурали да лизат може у потпуности да урони ткиво листа, ставите га у термални циклус или метално купатило и лизирајте на 95°Ц 5-10 минута.
Додати 50ул раствора за неутрализацију пуфера П2 и добро промешати.Добијени лизат се може користити као шаблон и додати у ПЦР реакциони систем.
Напомена: Количина шаблона је између 5-10% ПЦР система и не би требало да прелази 20% (на пример, у ПЦР систем од 20 μл, додајте 1-2 μл раствора за лизу, не више од 4 μл).
Корак 6
ПЦР реакција
Након центрифугирања ПЦР реакционе епрувете, она се ставља у ПЦР инструмент ради амплификације.
Објава:
Реакција користи непречишћени шаблон за амплификацију, тако да је број циклуса амплификације 5-10 циклуса више него када се користи пречишћени ДНК шаблон.
Корак 7
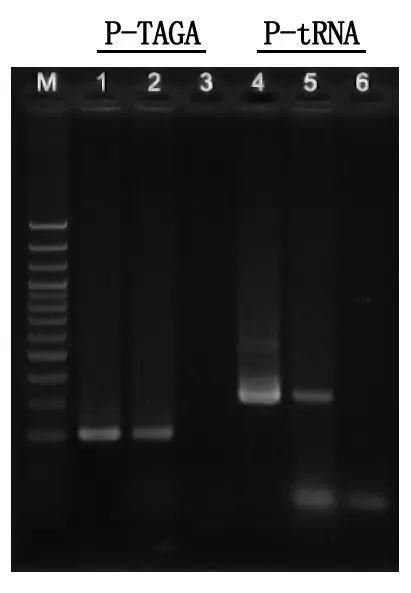
Детекција електрофорезом и анализа резултата
М: ДНК лествица од 100 бп
1\4: Метода пречишћене ДНК
2\5: Директна ПЦР метода
3\6: Празна контрола
КЦ:
Резултати испитивања различитих контрола постављених у експерименту треба да испуњавају следеће услове.У супротном, потребно је анализирати узрок проблема и поново извршити тест након што се проблем отклони.
Табела 1. Нормални резултати испитивања различитих контролних група
*Када се плазмид користи као позитивна контрола, резултат теста ендогеног гена може бити негативан
Резултат пресуде:
А. Резултат теста ендогеног гена узорка је негативан, што указује да се ДНК погодна за обичну ПЦР детекцију не може екстраховати из узорка или екстрахована ДНК садржи инхибиторе ПЦР реакције и ДНК треба поново да се екстрахује.
Б. Резултат теста ендогеног гена узорка је позитиван, а резултат теста егзогеног гена негативан, што указује да је ДНК погодна за обичну ПЦР детекцију екстрахована из узорка и може се проценити да ген КСКСКС није детектован у узорку.
Ц. Резултат теста ендогеног гена узорка је позитиван, а резултат теста егзогеног гена је позитиван, што указује да је ДНК погодна за обичну ПЦР детекцију екстрахована из узорка, а ДНК узорка садржи КСКСКС ген.Експерименти за потврду могу се даље спроводити.
Корак 8
Прајмери за детекцију дизајна
Након експеримента, користите 2% раствор натријум хипохлорита и 70% раствор етанола да обришете експериментално подручје како бисте спречили загађење животне средине.
Време поста: Сеп-08-2021