Преглед
Брза идентификација трансгених биљака
Текст/Тонг Иуцхенг
Експериментална операција/Хан Јинг
Уредник/Вен Иоујун
Вордс/1600+
Предложено време читања/8-10 минута
Брза идентификација трансгених биљака
Као новајлија у лабораторији, није добар посао издвојити позитивне биљке из гомиле биљака са ниском стопом конверзије.Прво, ДНК се мора издвојити из великог броја узорака један по један, а затим ће се страни гени открити ПЦР-ом.Међутим, резултати су често празнине и траке са неколико ставки повремено, али је немогуће утврдити да ли постоје пропуштене детекције или лажне детекције..Да ли је беспомоћно суочити се са таквим експерименталним процесом и резултатима?Не брини, брат те учи како да лако и прецизно одстрањујеш трансгене позитивне биљке.
Корак 1: Прајмери за детекцију дизајна
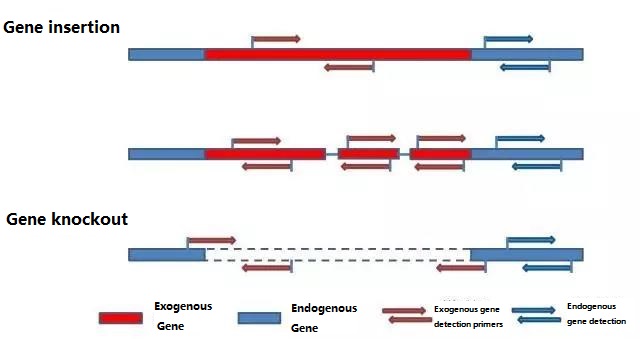
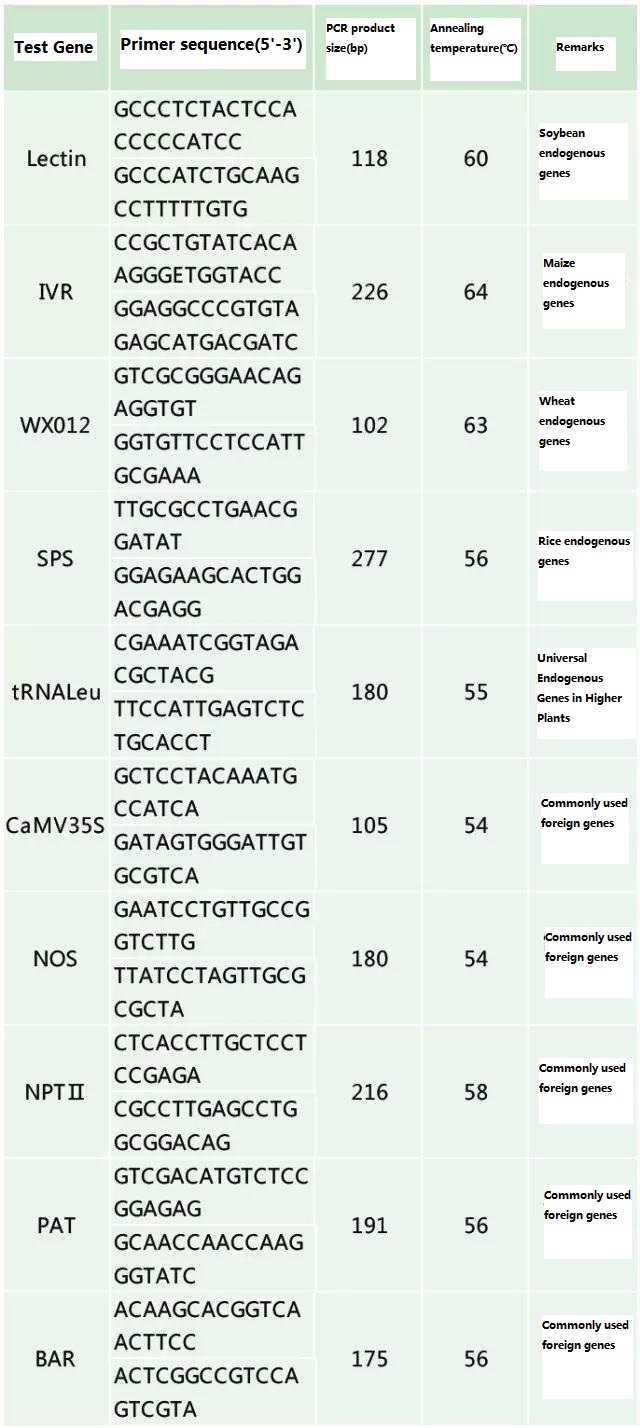
Одредите ендогени ген и егзогени ген који ће се детектовати према узорку који се тестира и изаберите репрезентативну секвенцу од 100-500 бп у гену за дизајн прајмера.Добри прајмери могу осигурати тачност резултата детекције и скратити време детекције (погледајте додатак за најчешће коришћене прајмере за детекцију).
Белешка:
Ново дизајнирани прајмери треба да оптимизују реакционе услове и провере тачност, прецизност и границу детекције пре него што изврше детекцију великих размера.
Корак 2:Развити експериментални протокол

Позитивна контрола: Користите пречишћену ДНК која садржи циљни фрагмент као шаблон да бисте утврдили да ли су ПЦР реакциони систем и услови нормални.
Негативна/празна контрола: Користите ДНК шаблон или ддХ2О који не садржи циљни фрагмент као шаблон за откривање да ли постоји извор контаминације у ПЦР систему.
Интерна референтна контрола: користите комбинацију прајмера/сонде ендогеног гена узорка који се тестира да бисте проценили да ли се шаблон може детектовати ПЦР-ом.
Белешка:
Позитивне, негативне/празне контроле и интерне контроле треба да буду постављене за сваки тест да би се проценила валидност експерименталних резултата.
Корак 3: Припрема експеримента

Пре употребе, проверите да ли је раствор равномерно измешан.Уколико дође до падавина, пре употребе га је потребно растворити и промешати према упутству.2×ПЦР мешавину треба пипетирати и мешати више пута микропипетом пре употребе да би се избегла неравномерна дистрибуција јона.
Белешка:
Извадите упутства и пажљиво их прочитајте, а пре експеримента извршите припреме строго у складу са упутствима.
Корак 4: Припремите ПЦР реакциони систем
Према експерименталном протоколу, помешати прајмере, Х2О, 2×ПЦР мешати, центрифугирати и дистрибуирати у сваку реакциону епрувету.
Белешка:
За обимно или дуготрајно тестирање, препоручује се употреба ПЦР реакционог система који садржи УНГ ензим, који може ефикасно избећи контаминацију аеросола узроковану ПЦР производима.
Корак 5: Додајте шаблон за реакцију

Коришћењем Дирецт ПЦР технологије, нема потребе за заморним процесом пречишћавања нуклеинске киселине.Шаблон узорка се може припремити у року од 10 минута и додати у одговарајући ПЦР реакциони систем.
Белешка:
Метода лизе има бољи ефекат детекције, а добијени производ се може користити за вишеструке реакције детекције.
5.1: Директни ПЦР листова
Према величини слике у упутству, исећи ткиво листа пречника 2-3мм и ставити га у ПЦР реакцијски систем.
Напомена: Уверите се да су фрагменти листа потпуно уроњени у ПЦР реакциони раствор и немојте додавати превише ткива листа.
5.2: Метода лизе листова
Исеците ткиво листа пречника 5-7мм и ставите га у епрувету за центрифугу.Ако изаберете зрело лишће, избегавајте коришћење ткива главне вене листа.Одпипетирајте 50 ул пуфера П1 лизата у епрувету за центрифугирање да бисте осигурали да лизат може у потпуности да урони ткиво листа, ставите га у термални циклус или метално купатило и лизирајте на 95°Ц 5-10 минута.


Додати 50ул раствора за неутрализацију пуфера П2 и добро промешати.Добијени лизат се може користити као шаблон и додати у ПЦР реакциони систем.
Напомена: Количина шаблона треба да буде између 5-10% ПЦР система и не би требало да прелази 20% (на пример, у ПЦР систему од 20 μл, додајте 1-2 μл пуфера за лизу, не више од 4 μл).
Корак 6: ПЦР реакција

Након центрифугирања ПЦР реакционе епрувете, ставите их у ПЦР инструмент за амплификацију.
Белешка:
Реакција користи непречишћени шаблон за амплификацију, тако да је број циклуса амплификације 5-10 циклуса више него када се користи пречишћени ДНК шаблон.
Корак 7: Детекција електрофорезе и анализа резултата

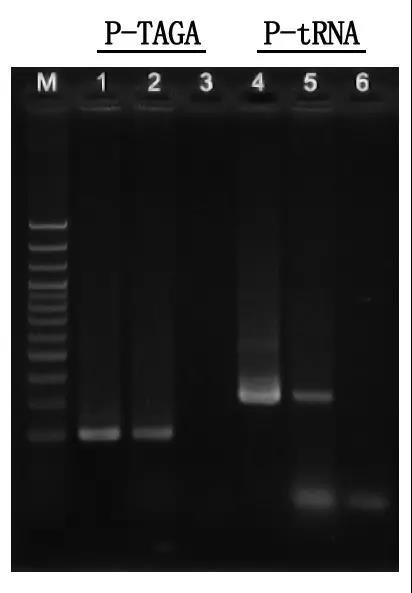
М: 100бп ДНК лествица
1\4: Метода пречишћене ДНК
2\5: Директна ПЦР метода
3\6: Празна контрола
Контрола квалитета:
Резултати теста различитих контрола постављених у експерименту треба да испуњавају следеће услове.У супротном, потребно је анализирати узрок проблема и поново извршити тест након што се проблем отклони.
Табела 1. Нормални резултати испитивања различитих контролних група

*Када се плазмид користи као позитивна контрола, резултат теста ендогеног гена може бити негативан
Резултат пресуде:
А. Резултат теста ендогеног гена узорка је негативан, што указује да се ДНК погодна за обичну ПЦР детекцију не може екстраховати из узорка или екстрахована ДНК садржи инхибиторе ПЦР реакције и ДНК треба поново да се екстрахује.
Б. Резултат теста ендогеног гена узорка је позитиван, а резултат теста егзогеног гена је негативан, што указује да је ДНК погодна за обичну ПЦР детекцију екстрахована из узорка и може се проценити да ген КСКСКС није детектован у узорку.
Ц. Резултат теста ендогеног гена узорка је позитиван, а резултат теста егзогеног гена је позитиван, што указује да је ДНК погодна за обичну ПЦР детекцију екстрахована из узорка, а ДНК узорка садржи КСКСКС ген.Експерименти за потврду могу се даље спроводити.
Корак 8: Дизајн прајмера за детекцију

Након експеримента, користите 2% раствор натријум хипохлорита и 70% раствор етанола да обришете експериментално подручје како бисте спречили загађење животне средине.
слепо црево
Табела 2. Често коришћени прајмери за општу ПЦР детекцију генетски модификованих биљака
Референтни документ:
СН/Т 1202-2010, Квалитативна ПЦР метода детекције за генетски модификоване биљне састојке у храни.
Саопштење Министарства пољопривреде 1485-5-2010, Испитивање састојака генетски модификованих биљака и њихових производа - пиринча М12 и његових деривата.
Време поста: 09.06.2021








